ПЗ 12: Структура, склад і властивості м’язової тканини. Амінокислотний склад м’язової тканини. Головні білки м’язової тканини, їх найважливіші властивості.
Практичне заняття 12
Тема : Структура, склад і властивості м’язової тканини. Амінокислотний склад м’язової тканини. Головні білки м’язової тканини, їх найважливіші властивості.
Мета: Вивчення структури, складу і властивостей м’язової тканини. Амінокислотний склад м’язової тканини. Головні білки м’язової тканини, їх найважливіші властивості.
Завдання 1. Вивчити структуру, складу і властивості м’язової тканини.
Завдання 2. Ознайомитися із амінокислотним складом м’язової тканини.
Завдання 3. Ознайомитися із головними білками м’язової тканини, їх найважливішими властивостями.
1. Вивчення структури, складу і властивостей м’язової тканини.
М’язова тканина — це частина м’яса, що має найбільшу поживну цінність. Вона є сукупністю м’язових волокон і сполучнотканинних оболонок, що кількісно переважають.
За морфологічною будовою розрізняють посмуговану мускулатуру, до якої належать скелетні м’язи, і гладку, що входить до складу тканин травного каналу, діафрагми, кровоносних судин, матки та ін.
Мускулатурою змішаного типу є серцевий м’яз.
Найбільший інтерес у технології становить посмугована скелетна мускулатура. Основним морфологічним і функціональним тканинним елементом посмугованої мускулатури є м’язове волокно.
М’язові волокна — це своєрідна гігантська багатоядерна клітина завтовшки від 10 до 100 мкм і завдовжки 12 см і більше. Структура м’язового волокна дуже складна. Поверхня його вкрита еластиновою оболонкою — сарколемою.
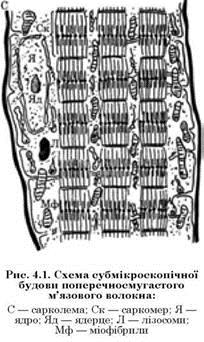
Крім сарколеми, в структурі м’язового волокна можна розрізнити тонкі поздовжні структури — міофібрили, а також ядра і кілька органел: мітохондрії, рибосоми, лізосоми та ін. Меншу частину клітин (35 — 40 %) становить саркоплазма, що повністю оточує всі інші утворення.
М’язові волокна складаються в первинні м’язові пучки. У пучках волокна з’єднані найтоншими прошарками сполучної тканини, зв’язаними з волокнами ендомізієм. Ендомізій утворюється тонкими і ніжними колагеновими й еластиновими волокнами, зібраними в пучки, вільний простір між ними заповнений проміжною речовиною.
Первинні м’язові пучки об’єднуються в пучки вторинні і т.д. Пучки вищого порядку вкриті міцнішою сполучнотканинною оболонкою — перемізієм і в сукупності складають м’яз. Ендомізій і перемізій утворюють своєрідний каркас або строму м’язів. їх міцність впливає на жорсткість м’язової тканини. Тому на практиці їх виділяють в окрему категорію внутрішньом’язової сполучної тканини.
М’яз також вкритий оболонкою — епімізієм. Перемізій і епімізій побудовані з колагенових волокон різної структури і міцності, що утворюють більш-менш складні сплетіння і вміщують різну кількість еластинових волокон. У перемізії й епімізії м’язів деяких видів відгодованих тварин є жирові клітини, що утворюють так звану «мармуровість м’яса» на його поперечному розрізі.
Сарколема побудована з двох шарів з ліпідним прошарком. Внутрішній (плазматичний) шар має вигляд мембрани завтовшки 0,1 мкм; зовнішній — базальний шар, складається з густої сітки волокон двох видів: переважно колагенових (діаметром близько 0,2 нм) і безструктурних еластинових.
Сарколема має вибіркову проникність. За життя тварин через неї проходять складові молекул вуглеводів, жирних кислот, амінокислот, білків. їх переміщення залежить від осмотичного тиску і активної регуляції сарколеми. її проникність регулюється нервовою системою і змінюється під час роботи м’язів, пов’язаної з підкисненням вмісту волокна.
Міофібрили є активними скорочувальними елементами м’язового волокна, що займають більшу частину клітини (близько 60 — 65 %). Це волокнисті посмуговані структури (завтовшки 1 — 2 нм), які розміщені в протоплазмі м’язового волокна поздовжньо направленими паралельними пучками.
Під мікроскопом за великого збільшення можна побачити ділянки, що рівномірно чергуються, одні з яких у прохідному світлі здаються темними, інші — світлішими.
При дослідженні в поляризаційному мікроскопі темні ділянки міофібрил виявляють подвійне променезаломлення (анізотропні диски, або диски А), а світлі не мають таких властивостей (ізотропні диски, або диски Л). Така оптична неоднорідність цих ділянок зумовлена неоднаковою їх будовою та білковим складом.
|
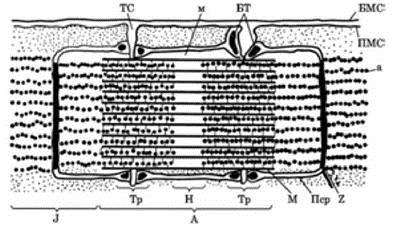
Рис. 2. Схема будови саркомера у розслабленому стані: БМС — базальна мембрана сарколеми; ПМС — плазматична мембрана сарколеми; А — анізотропний диск; J — ізотропний диск; Н — світлий диск; М — смужка; Z — пластина; а — активні протофібрили; м — міозинові протофібрили; ТС — канали Т-системи; БТ — бокові тяжі; Тр — тріади саркоплазматичного ретикулума; Пср — поздовжні канали саркоплазматичного ретикулума |
Основні ділянки міофібрил, обмежені мембранами Z, називають саркомером. Довжина саркомера 2 — 3 нм. Кожна міофібрила складається з кількох саркомерів.
Кожну міофібрилу можна розщепити (наприклад, за допомогою ультразвуку) на численні найтонші нитки, які видно тільки під електронним мікроскопом. Ці елементарні волоконця, що складають міофібрили, називають протофібрилами. Розрізняють товсті й тонкі протофібрили (нитки). Товсті нитки (діаметром близько 100 нм і завдовжки 450 нм) побудовані з білка міозину, розташовані паралельними рядами в диску А. Посередині диска А в зоні Н товсті нитки збільшуються в діаметрі, утворюючи зону м.
Тонкі нитки (діаметром близько 58 нм), що складаються з білка актину, ідуть від лінії Z через диск їхні кінці знаходяться між товстими нитками в зоні А. У зоні Н тонких ниток немає. Товсті й тонкі нитки з’єднані перемичками (містками) завтовшки приблизно 30 нм.
Будова тонких і товстих ниток доволі складна. Товсті складаються з паралельно розташованих, стиснених молекул міозину (кожна нитка, що входить у диск А, вміщує від 200 до 400 молекул білка). Через певні проміжки (429 і 143 нм) уздовж нитки розміщені містки, що стикаються з містками на тонких нитках. Вони ніби закручені навколо спіралі і утворюють піки, подібні до зубців (ніжок). Тонкі нитки складаються з двох спірально переплетених ланцюгів молекулярного актину (побудованих з мономерного актину). Один ланцюг закручений навколо іншого, осьового.
На поперечному розрізі міофібрил товсті й тонкі нитки орієнтовані так, що утворюють гексагональну структуру. Фібрили оточені й тісно пов’язані з особливою структурою, що складається з трубочок та бульбашок і називається саркоплазматичним ретикулумом.
Саркоплазма. У саркоплазмі потрібно розрізняти шар зернистої цитоплазми, що прилягає до ядер, і міжфібрилярну плазму, що заповнює проміжки між фібрилами.
Зерниста цитоплазма вміщує різні органоїди (організовані внутрішньоклітинні утворення, які беруть участь в основних життєвих функціях).
Ядра розташовані по периферії клітини під оболонкою. Вони мають овальну, плоску форму. Структура ядер неоднорідна. В них вміщуються переважно дезоксирибонуклеопротеїни. Ядра вкриті надтонкою оболонкою, що складається з двох шарів білкових молекул, між якими лежить ліпідний прошарок.
Мітохондрії — це утворення кулястої або видовженої форми діаметром 0,7 — 1,0 мкм (2 — 7 мкм). Вони обмежені двошаровою мембраною завтовшки до 180 нм, що складається з глобулярних білкових молекул та шару молекул ліпідів. У середині мітохондрії розташовані також двошарові мембрани, що складаються з білково-фосфоліпідних комплексів у вигляді перегородок, гребенів.
Рибосоми (саркосоми) — це утворення круглої або овальної форми діаметром від 200 до 300 нм. Вони складаються переважно з білкової оболонки і рибонуклеїнових кислот (РНК).
Лізосоми — нестійкі утворення сферичної форми (середній діаметр близько 0,4 мкм), оточені ліпопротеїдною мембраною. У структурі локалізовані різні гідролітичні ферменти. Фізіологічною функцією лізосомів є внутрішньоклітинне перетравлення.
М’язова тканина характеризується складним хімічним складом. До неї входить значна кількість побічних речовин, вміст і властивості яких можуть змінюватися залежно від багатьох факторів як за життя тварин (передзабійне утримання), так і відразу після забою.
Масова частка основних хімічних речовин у м’язовій тканині (препарованій) ссавців становить, %:

Вміст води у м’язах коливається залежно від віку тварин: чим вони молодші, тим більше вологи в м’ясі. Вміст води в різних групах м’язів неоднаковий і зменшується у міру збільшення вмісту жиру.
Після висушування м’язової тканини сухий залишок становить близько 30 %, у тому числі органічних речовин 20 — 28 %; неорганічних солей — 1,0 — 1,5 %.
Основним компонентом органічних речовин тканини є білки. На їхню частку припадає близько 80 % сухого залишку або 16,5 — 20,9 % маси тканини. Чільне місце належить численним екстрактивним речовинам (азотистим і безазотистим), що виконують важливу роль у біохімічних перетвореннях м’язів. Деякі з них є проміжними або кінцевими продуктами обміну. До складу сухого залишку входять також жири й інші ліпіди. У м’язовій тканині містяться різні вітаміни.
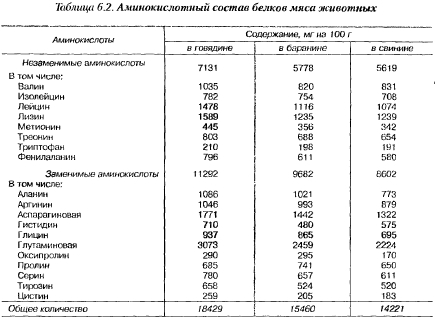
2. Ознайомитися із амінокислотним складом м’язової тканини.
3. Ознайомитися із головними білками м’язової тканини, їх найважливішими властивостями.
Білкові речовини складають 60-80 % сухого залишку м'язової тканини. З них побудовані структурні компоненти кліток і міжклітинної речовини. Білки м'язової тканини впливають не тільки на харчову і біологічну цінність м'яса, але і зумовлюють стан физико-хімічних, структурно-механических і технологічних показників сировини (клейкість, в'язкість, що водозв'язуючу здатність, рН і тому подібне) і готової продукції (соковитість, ніжність, вихід). Вони різні по амінокислотному складу, будові, біологічним функціям, фізико-хімічним показникам, зокрема розчинності. Розчинні білки входять, в основному, до складу плазми, солерозчинні утворюють міофібрили. Нерозчинні у водно-сольових розчинах фракції умовно називають білками строми, до складу яких входять білки сарколеми, ядер і внутріклітинні сполучнотканинні білки.
Міоген складається із комплексу міогенів А, В і С. Міоген становить близько 20 % від усіх білкових волокон і є повноцінним білком. Він розчиняється у воді, утворюючи 20 — 30%-ві гомогенні розчини з невеликою в’язкістю. Температура денатурації вільного від солей міогену 55 — 60 °С, ізоелектрична точка в інтервалі рН 6,0 — 6,5. З часом частина міогену переходить у нерозчинний стан.
Міоглобін. Вміст міоглобіну в м’язовій тканині становить близько 1 % і залежить від віку тварин і виду м’язів. Це розчинний у воді білок. Міоглобін — пігмент хромопротеїд, який складається із глобіну і гему (феропротопорфірин), що координаційно пов’язані між собою. Глобін, що входить до складу протеїду, за амінокислотним складом є повноцінним білком. На одну молекулу міоглобіну припадає один гем. Температура денатурації міоглобіну близько 60 °С. Денатурація міоглобіну супроводжується відщепленням простетичної групи. Міоглобін здатен приєднувати оксид азоту, сірководень та кисень за рахунок додаткових зв’язків. У разі приєднання кисню утворюється оксиміоглобін, який з часом переходить у метміоглобін буро-коричневого кольору. При цьому залізо віддає один електрон. Під дією відновників метміоглобін знову відновлюється до міоглобіну.
Міоглобін забарвлений у темно-червоний колір і зумовлює природне забарвлення м’язової тканини. Інтенсивність забарвлення м’яса залежить від вмісту міоглобіну. При переході міоглобіну в метміоглобін забарвлення м’яса стає коричневим, воно помітне, коли змінюється близько 50 % міоглобіну за схемою:
Міоглобін крім передавача кисню виконує також роль міцного фактора, що полегшує проникнення кисню в середину клітин. Унаслідок цього у м’язах, що працюють інтенсивно, вміщується відносно більше міоглобіну, тому вони мають темніше забарвлення (наприклад, м’язи ніг і шиї великої рогатої худоби, м’язи коней), ніж м’язи, що не працюють або працюють менш інтенсивно.
Глобулін Х — білок, що становить близько 20 % від усієї кількості білкових речовин м’язової клітини. Він є повноцінним, не розчиняється у воді, але розчиняється в сольових розчинах навіть низької концентрації. Температура денатурації при рН 6,5 близько 50 °С, при рН 7,0 — 80 °С, ізоелектрична точка лежить близько рН 5,2. Глобуліну Х притаманні ферментативні властивості.
Міоальбуміни складають близько 1—2 % білкових речовин м’язового волокна. Вони розчиняються у воді і не розчиняються в кислому середовищі, оскільки мають ізоелектричну точку близько рН 3 - 3,5, температура їх денатурації 45 - 47 °С.
Нуклеопротеїди. До складу білків саркоплазми нуклеопротеїди входять у невеликій кількості. Вони зосереджені переважно в рибосомах, саркоплазматичному ретикулі. Особливістю їх є наявність у структурі молекули рибози, тобто нуклеїнові кислоти нуклеопротеїдів саркоплазми є рибонуклеїновими кислотами (РНК).
Установлено, що білки саркоплазми мають желеутворювальну здатність, особливо за наявності аденозинтрифосфорної кислоти (АТФ). За високих концентрацій Са++ гель розріджується. Желе- утворення білків саркоплазми залежить від наявності в середовищі фрагментів саркоплазматичного ретикулума. Видалення цих фрагментів не дає білкам можливості утворювати гель, що пов’язано з властивостями ретикулума, з його роллю в переміщенні Са.
Білки міофібрил. Міозин — повноцінний фібрилярний білок, що становить близько 40 % білкових волокон, добре перетравлюється. Його молекули мають виражену ферментативну активність, легко взаємодіють між собою і актином, мають високу водозв’язувальну, гелеутворювальну і емульгуючу здатності.
Здатність зв’язувати катіони металів та деякі інші фізико-хімічні властивості міозину пояснюються особливостями складу його первинної структури і будовою молекул. Близько 30 % усього амінокислотного складу міозину припадає на частку дикарбонових кислот (глютамінової і аспарагінової), що надає білку кислотного характеру і зумовлює специфічну здатність зв’язувати йони калію, кальцію і магнію за рахунок великої кількості вільних карбоксильних груп. Тому ізоелектрична точка міозину лежить у кислій зоні при рН 5,4 — 5,5.
Здатність міозину з’єднуватися з актином та його АТФ-активність залежать від наявності в молекулі білка вільних сульфгідрильних груп.
Міозин має ферментативну активність, каталізує гідролітичний розпад аденозинтрифосфорної кислоти на аденозиндифосфорну і фосфорну кислоти:
 АТФ + Н2 О →Міозин АДФ + Н3РО4 + 8 ккал
АТФ + Н2 О →Міозин АДФ + Н3РО4 + 8 ккал
Розпад АТФ під впливом міозину супроводжується відокремленням неорганічного фосфату та виділенням з високоенергетичного зв’язку нуклеотиду великої кількості енергії, яка використовується для здійснення акту м’язового скорочення. Аденозинтрифосфатазна активність міозину залежить від наявності в складі молекули вільних СН-груп і деяких солей (кальцію, магнію) та рН середовища. Молекули міозину легко асоціюють одна з одною, утворюючи часточки з молекулярною масою, яка приблизно в 8 разів більша за вихідну. Крім того, міозин взаємодіє з іншими білками і компонентами клітин, наприклад міозин утворює міцний комплекс з актином і глікогеном.
У клітинах міозин здатний бути у комплексі з ліпідами (в складі цієї фракції є холестерин). Міозин денатурує за температури 45 - 50°С.
Актин становить 12 — 15 % від усіх м’язових білків. Він є основним компонентом тонких ниток у структурі міофібрил м’язового волокна. Актин — повноцінний білок, що добре перетравлюється харчовими ферментами.
Актин може існувати в двох формах, різних за фізико-хімічними властивостями: Г-актин (молекули кулеподібні) і фібрилярний Ф-актин (молекули витягнуті).
У волокнах живих м’язів у стані спокою актин перебуває в глобулярній і фібрилярній формах. Фібрилярний актин може переходити у глобулярний і навпаки.
Так, під впливом розчинних солей лужних і лужноземельних металів у певних концентраціях актин переходить у фібрилярну форму в результаті лінійної агрегації молекул. При видаленні цих солей він знову перетворюється на глобулярний актин. Фібрилярний актин утворюється також при заморожуванні м’язів, унаслідок підвищення концентрації в них солей.
Актоміозин — комплексний білок. Він складається з двох білків актину і міозину. За певних умов міозин ЯН-групами здатний взаємодіяти з оксигрупами фібрилярного актину, утворюючи актоміозин. Співвідношення актину і міозину в м’язах 1 : 3. Актоміозин має інші властивості, ніж актин і міозин. Скорочуючись, він зумовлює скорочення м’язів за життя тварин та при посмертному задубінні. Істотну роль у цьому процесі відіграє АТФ. За наявності аденозинтрифосфорної кислоти і залежно від її концентрації актоміозин частково або повністю дисоціює на актин та міозин. У складі м’язової тканини актоміозин залежно від умов може перебувати в асоційованій або частково дисоційованій формі, що вміщує незначну кількість актину. Дисоціація актоміозину на вихідні компоненти відбувається при підвищеній концентрації солі. При розведенні актоміозин випадає в осад. Температура денатурації актоміозину 42 - 48 °С. Актоміозин не розчиняється у воді.
Тропоміозин — структурний білок міофібрил. Він становить 4 — 7 % міофібрилярних білків. За амінокислотним складом тропоміозин відрізняється від міозину: в його молекулі немає триптофану. Водночас він має високий вміст дикарбонових і основних амінокислот. Характерною особливістю білка є стійкість до денатурації. В 0,1 М сольовому розчині тропоміозин не осаджується при нагріванні до 100 °С при рН 6,3. Тропоміозин міститься в міофібрилах, в яких він зосереджений в ізоторопних дисках в зоні ^-мембран. Тропоміозин є складним комплексом з двох білків: тропоміозину Б і тропіну. Перший збільшує чутливість актоміозину до Са2+ й ініціює АТФ-активність міозину.
У процесі скорочення м’язів тропоміозин виконує функцію, пов’язану з передачею кальцію.
Крім перелічених білків у міофібрилах вміщуються інші білки (водорозчинні), функції яких ще до кінця не виявлені. Серед них можна виділити а-актинін, який сильно активує взаємодію Ф-актину з тропоміозином. Інший білок, виділений з міофібрил (Р-актинін), оточує нитки Ф-актину в дисках.
Білки строми. До цієї групи належать білки, що складають сарколему і пухку сполучну тканину, які об’єднують м’язові волоконця в м’язові пучки. На поверхні сарколеми розташовані сполучнотканинні волокна, що складаються з білків сполучної тканини (протеїноїдів): колагену, еластину і ретикуліну. У міжклітинному просторі м’язової тканини містяться муцини і мукоїди — слизоподібні білки, що виконують захисні функції і полегшують ковзання м’язових пучків.
Питання для закріплення та самоконтролю.
- Охарактеризуйте структуру м’язової тканини.
- Охарактеризуйте білковий склад м’яса.
- Охарактеризуйте амінокислотний склад м’яса забійних тварин.